Intérêt de lathoracoscopie
Sommaire
- Les épanchements péricardiques sont un défi diagnostic pour le praticien, et les traitements à envisager sont complexes.
Auteurs : Drs. S. Libermann et C. Bille 31-12-2008
Centre Hospitalier Vétérinaire des Cordeliers, 29-35 avenue du Maréchal Joffre, 77100 Meaux.
E-mail : slibermann@chvcordeliers.com
Cet article a été publié dans : PratiqueVet (2008) 43 : p 652-656
Objectifs pédagogiques
- Savoir diagnostiquer les épanchements péricardiques et leur évolution vers la tamponnade.
- Connaître l’intérêt de l’examen thoracoscopique pour la réalisation d’une péricardectomie thérapeutique.
Crédit de formation continue
La lecture de cet article ouvre droit à 0,05 CFC. La déclaration de lecture, individuelle et volontaire, est à effectuer auprès du CNVFCC.
Intérêt de lathoracoscopie dans le diagnostic et le traitement des tamponnades
La thoracoscopie apporte une avancée certaine pour déterminer la cause de l’épanchement, ainsi qu’une diminution de la morbidité postopératoire après péricardectomie.
Résumé
Face à un épanchement péricardique, la difficulté pour le praticien réside dans le fait d’en déterminer l’origine idiopathique ou tumorale. Cela conditionne le pronostic, mais également le choix d’un traitement médical ou chirurgical. Lorsqu’un geste chirurgical est nécessaire, le choix d’une technique mini-invasive est préférable en réalisant la péricardectomie lors d’un examen thoracoscopique.
Les épanchements péricardiques en chiffre
Les épanchements péricardiques chez le Chien peuvent avoir différentes origines : cinquante-sept pour cent sont d’origine tumorale (hémangiosarcome, chémodectome, mésothéliome) 1, 19 % sont d’origine idiopathique, 14 % sont provoqués par une cardiopathie et 10 % sont la conséquence de troubles divers (traumatisme, infection, syndrome urémique…).

Les races atteintes le plus fréquemment sont le Golden Retriever, le Berger Allemand, le Saint-Bernard, les chiens croisés et le Labrador Retriever 1.
Chez le Berger Allemand, 50 % des épanchements péricardiques sont d’origine tumorale 2.
Le Saint-Bernard et le Golden Retriever semblent au contraire prédisposés aux épanchements idiopathiques.
Une origine tumorale à la collection péricardique est plus souvent mise en évidence chez les races de petite taille et de taille moyenne 2.
De l’épanchement péricardique à la tamponnade : difficultés diagnostiques
Le tableau clinique varie peu en fonction de l’étiologie. Dans tous les cas, lorsque la pression exercée par le liquide d’épanchement dans le sac péricardique atteint environ 20 mmHg, l’oreillette droite n’a plus la possibilité de se remplir.
Cela conduit à une insuffisance circulatoire droite par défaut de remplissage : c’est la tamponnade.
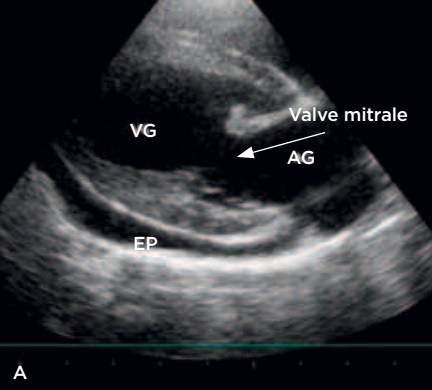
Photo 1A – Échographie cardiaque avant péricardiocentèse : coupe longitudinale droite 4 cavités VG : ventricule gauche, AG : auricule gauche, EP : épanchement péricardique.

Photo 1B – Échographie cardiaque après péricardiocentèse : coupe longitudinale droite 4 cavités. Noter la disparition de l’épanchement.
VG : ventricule gauche, AG : auricule gauche, EP : épanchement péricardique.
Les signes cliniques
Les signes cliniques les plus fréquemment rencontrés sont des bruits cardiaques assourdis, une faiblesse, la présence d’un liquide d’ascite et une intolérance à l’effort 2.
L’examen électrocardiographique est peu sensible pour diagnostiquer un épanchement péricardique 3.
Les radiographies thoraciques montrent le plus souvent une cardiomégalie 2,3,4.
L’échographie cardiaque est l’examen de choix
Elle permet d’objectiver la présence d’une tamponnade en visualisant un défaut de remplissage du cœur droit. Elle doit cependant être considérée comme tout examen complémentaire, avec cette particularité que ses sensibilité et spécificité dépendent du manipulateur. Le risque de conclure à tort à la présence d’une masse péricardique ou au contraire à ne pas visualiser une tumeur reste élevé, même pour les imageurs les plus expérimentés.
L’examen cytologique ne permet pas d’exclure une tumeur
L’examen cytologique du liquide d’épanchement peut également être à l’origine de nombreuses erreurs diagnostiques.
Plusieurs études ont montré 5, 6 que l’analyse cytologique du liquide d’épanchement ne permet de suspecter une tumeur que chez 40 % des animaux atteints de mésothéliome (faux négatifs). De plus, des cellules mésothéliales activées dont l’aspect est compatible avec une origine tumorale ont été identifiées chez tous les animaux atteints de mésothéliomes, ainsi que chez 60 % des animaux dont l’épanchement était d’origine idiopathique (faux positifs) ; l’analyse cytologique du liquide d’épanchement ne permet pas d’exclure une origine tumorale dans 89 % des cas (faux positifs).
En résumé, déterminer la cause d’une tamponnade nécessite souvent le recours à différents examens (multiples échocardiographies, analyses cytologiques, analyses histopathologiques), dont les résultats doivent être confrontés systématiquement aux données de l’anamnèse et à l’évolution clinique.
Un traitement de l’urgence, puis si possible chirurgical
La péricardiocentèse
C’est le traitement d’urgence d’un épanchement péricardique 2, 4, 6. Elle permet de stabiliser l’état cardiovasculaire de l’animal et d’obtenir du liquide, dont l’analyse constitue une avancée diagnostique.
La péricardectomie
Cependant, 40 % des épanchements d’origine idiopathique récidivent 2.
Après deux récidives, il est recommandé d’avoir recours à une péricardectomie : l’analyse histologique du péricarde reste l’examen le plus fiable pour confirmer l’origine de l’épanchement. Pour cela, la chirurgie mini-invasive permet une meilleure gestion postopératoire et améliore la récupération 6.
Un traitement du mésothéliome par chimiothérapie a été décrit 7. Il repose sur l’administration de cisplatine par voie intrathoracique, associée à la doxorubicine.
Une bonne gestion médicale ou chirurgicale des tamponnades permet dans la plupart des cas d’obtenir une guérison ou une rémission longue : la durée de survie dépend avant tout de la cause de l’épanchement 2_4, 8, 9.
Les animaux atteints d’hémangiosarcome ont une durée moyenne de survie de 1 à 3 mois 10. Les chémodectomes évoluent souvent lentement, permettant une survie moyenne de 661 jours chez les animaux ayant subi une péricardectomie 11. La médiane de survie des animaux atteints de mésothéliome et ayant subi une péricardectomie est de 13,6 mois.
Soixante-douze pour cent des animaux atteints d’épanchement péricardique d’origine idiopathique étaient vivants 18 mois après le diagnostic 10.
La péricardectomie thoracoscopique en pratique
Rétablir un remplissage cardiaque droite avant intervention
Les animaux sont vus entre 5 et 15 jours après la ponction d’une quantité maximale de liquide péricardique.
Cet intervalle permet d’assurer un drainage médical complet de l’ascite après le rétablissement du remplissage cardiaque droit normal, et ainsi de permettre une amplitude de mouvement optimale du diaphragme avant l’intervention.
Dans ces conditions, si la fonction cardiaque est effectivement normalisée le jour de l’anesthésie générale, le patient ne dépasse pas le niveau II dans la classification ASA (American Society of Anesthesiologists), ce qui permet une conduite anesthésique plus aisée.
La prise en charge pré-opératoire de la douleur est nécessaire, elle peut associer des morphiniques (chlorhydrate de morphine 0,2 mg/kg IV, 30 minutes pré-opératoires ; fentanyl 5-10 µg/kg/h administré en per-opératoire au pousse seringue), des anti-inflammatoires nonstéroïdiens (AINS) ou stéroïdiens (AIS), des α2-agonistes.
Une prise en charge immédiate de la fonction respiratoire est nécessaire
Une ventilation mécanique est réalisée dès l’induction anesthésique ; elle est monitorée par suivi de la capnographie, afin de maintenir une pCO2 autour de 35 mmHg.
L’amplitude respiratoire est volontairement limitée avec une pression d’insufflation inférieure à 10 cm d’eau ; la fréquence respiratoire est donc élevée afin de limiter l’augmentation de la capnie.
La faible amplitude de mouvement des poumons lors de l’insufflation facilite le passage des instruments dans la cavité thoracique.
Le maintien du circuit de ventilation en pression expiratoire positive minimale de 5 cm d’eau est souhaitable.
Durant une anesthésie générale, et particulièrement lorsque le vide pleural est modifié, certains alvéoles ne se développent plus et cloisonnent un volume pulmonaire non fonctionnel.
Ces alvéoles étant recrutés en fin d’expiration, la conservation d’une pression positive permanente dans le circuit d’anesthésie limite ce phénomène.
Préparation du site opératoire
Les deux hémithorax sont tondus et préparés aseptiquement, afin de permettre une conversion rapide si elle est nécessaire.
Le chien est placé en décubitus dorsal, la tête très discrètement en position proclive.
Le drapping est classique ; les deux hémithorax sont protégés par un jersey afin de garantir l’asepsie même si une conversion rapide est nécessaire.
Mise en place du thoracoscope
La peau est incisée en arrière du processus xiphoïde, 0,3 mL de bupivacaïne (Marcaïne® [H]) sont injectés dans le muscle, puis une chemise de 10 mm munie d’un robinet est mise en place aidée d’un mandrin à garde mousse (Photo 2).
Le mandrin est orienté légèrement vers le bas, afin de pénétrer l’hémithorax droit ou gauche, et avec un angle de 30° environ avec l’axe sternal afin d’éviter le cœur.
Une fois en place, le mandrin est retiré, le robinet est ouvert afin de créer un pneumothorax qui permettra de ménager une zone de travail entre le poumon et la paroi costale.
Une optique de 10 mm, 0°, est ensuite introduite dans la chemise ; l’hémithorax choisi est visité.
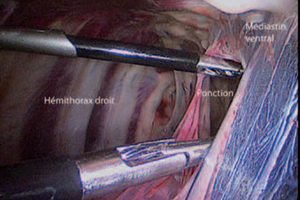
Sous contrôle endoscopique, un canal opérateur de 5 mm, muni d’un trocart, est introduit entre la 8e et la 9e côte du même côté, dans le quart ventral 8 (Photo 3), puis un second peut être placé si nécessaire entre la 5e et la 6e. A chaque fois, un bloc à la Marcaïne ® [H] est réalisé, afin de limiter la douleur postopératoire.
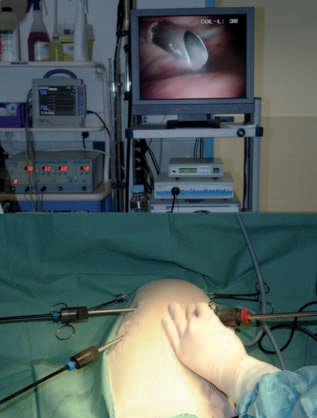
Photo 3 – Mise en place d’un canal opérateur à l’aide d’un suivi visuel.
La péricardioscopie
Une paire de ciseaux de Metzenbaum est ensuite introduite dans le canal opérateur le plus caudal, et utilisée afin de réaliser la section du médiastin sur toute sa longueur (Photo 4).
Cette étape rend l’hémithorax controlatéral accessible pour l’optique et les instruments cœlio-chirurgicaux. Un canal opérateur est placé de ce côté entre la 8e et la 9e côte (Photo 5).

Photo 4 – Ponction du médiastin ventralement au sac péricardique.

Photo 5 – Mise en place du second canal opérateur.
Une pince clamp est introduite par la porte antérieure ; elle permet de saisir le sac péricardique, et de le surélever.
Les ciseaux de Metzenbaum sont utilisés pour ponctionner le sac. Puis, l’ouverture est poursuivie aux ciseaux vers l’avant et vers l’arrière (Photo 6), jusqu’à ce qu’une fenêtre péricardique de 5 cm de côté soit retirée (Photo 7). La pince clamp est ensuite utilisée pour surélever un bord de la fenêtre et l’optique est introduite dans le sac péricardique afin de réaliser une péricardioscopie la plus complète possible.

Photo 6 – Ponction du sac péricardique.
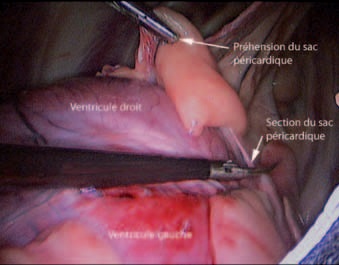
Photo 7 – Dissection et extraction du sac péricardique.
Les deux auricules sont visualisés (Photo 8), un hémangiosarcome est recherché sur l’auricule droite car il s’agit de sa localisation la plus fréquente.
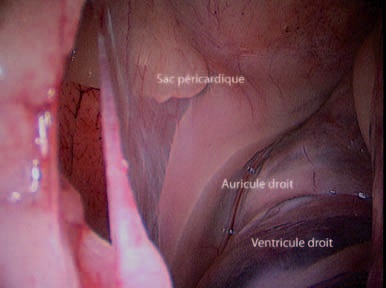
Photo 8 – Exploration visuelle du contenu du sac péricardique.
La visualisation peut être améliorée en gardant la porte xiphoïdienne et en utilisant une optique à 30°, 70° voire 90°.
La péricardectomie
Le sac péricardique réséqué est retiré par une porte intercostale et prélevé pour examen histopathologique.
L’intégralité de la face interne du sac péricardique visualisé, une biopsie supplémentaire peut également être pratiquée si nécessaire à l’aide d’une curette.
Une masse sur un auricule peut également être retirée entièrement ou biopsiée par voie thoracoscopique en utilisant une pince endo GIA® [H].
Le choix de la taille de la fenêtre péricardique est délicat : une taille trop importante expose au risque de hernie cardiaque à travers la brèche, une taille trop petite induit une récidive possible de l’épanchement après obstruction.
La taille de 5 cm semble la mieux adaptée 6.
Une résection subtotale du péricarde a également été décrite ; elle est possible lors de diagnostic de certitude d’une origine idiopathique.
Postopératoire immédiat
Un drain thoracique est enfin mis en place dans l’un des deux hémithorax, puis l’extrémité libre du drain est conduite à l’aide d’un clamp dans l’hémithorax opposé en prenant garde à ne pas le couder.
En postopératoire, le péricarde drainera facilement dans le thorax et le liquide péricardique sera récupéré par le drain.
Une aspiration continue est préférable si elle peut être maintenue 12 heures après l’intervention.
Un lavage du drain toutes les 2 heures associant du chlorhydrate de morphine et un anesthésique local de longue durée (bupivacaïne) est réalisé. Le drain est retiré entre 12 et 24 heures après l’intervention.
L’animal peut être rendu à ses propriétaires rapidement, la gestion de la douleur ne dépassant généralement pas 48 heures.
Points forts
|
Bibliographie
|
