Traitement de l’insuffisance cardiaque : principales classes thérapeutiques
Sommaire
- En l’absence malheureusement encore trop fréquente de traitement étiologique, la thérapeutique des cardiopathies consiste à s’opposer à leur conséquence grave : l’insuffisance cardiaque. Grâce à une meilleure classification des stades de l’insuffisance cardiaque, à l’apparition de nouveaux médicaments, à plusieurs études cliniques permettant de mieux connaître leurs effets bénéfiques et indésirables et souvent leurs interactions, le traitement de l’insuffisance cardiaque a fait des progrès immenses. Les différentes classes de médicaments s’adressent encore principalement aux animaux ayant décompensé.
© 2016 Elsevier Masson SAS. Tous droits réservés.
Auteurs : Drs. E. Bomassi et J.-F. Rousselot 2016
- J.-F. Rousselot, Docteur vétérinaire, ancien assistant de médecine de l’ENVA, membre titulaire de l’Académie Vétérinaire Email : jfrousselot@wanadoo.fr Clinique du clos des camélias, 72, boulevard Charles-de-Gaulle, 92700 Colombes, France.
- E. Bomassi, Docteur vétérinaire, diplôme d’études spécialisées vétérinaires en médecine interne, option Cardiologie (DESV). E-mail : ebomassi@chvcordeliers.com CHV des Cordeliers, 29, avenue du Maréchal-Joffre, 77100 Meaux, France.
Toute référence à cet article doit porter la mention : Rousselot JF, Bomassi E. Traitement de l’insuffisance cardiaque. Principales classes thérapeutiques. EMC – Vétérinaire 2016;0(0):1-15 [Article CD 1300]. Mots clefs : Insuffisance cardiaque ; Chien ; Chat ; Diurétiques ; Furosémide ; Torasémide ; IECA ; Pimobendane ; Antiarythmiques ; Bêtabloquants ; Inhibiteurs calciques Déclaration d’intérêts : les auteurs déclarent ne pas avoir de liens d’intérêts en relation avec cet article. Cet article a été publié dans : EMC – Vétérinaires 2016;0(0):1-15 [Article CD 1300].
- La polythérapie est quasiment toujours obligatoire. Elle est considérablement facilitée par la nouvelle appétence des médicaments, et par l’éducation thérapeutique du détenteur du chien ou du chat. Il reste encore de nombreuses inconnues. Le traitement, par exemple, des cardiomyopathies félines est au centre des préoccupations des cardiologues vétérinaires, mais la grande diversité de leurs phénotypes complique beaucoup la réalisation des études cliniques nécessaires pour objectiver l’efficacité du traitement envisagé.
© 2016 Elsevier Masson SAS. Tous droits réservés.
Introduction
L’insuffisance cardiaque (IC) se définit comme une incapacité du cœur à fournir, dans des conditions normales, c’est-à-dire sans hypovolémie, le débit sanguin nécessaire aux besoins métaboliques et fonctionnels des différents organes.
La défaillance du cœur est liée à une cardiopathie, qu’elle soit congénitale ou acquise. Elle peut s’exprimer cliniquement de façon suraiguë ou aiguë, mais son profil clinique est généralement d’installation plus lente, avec des signes congestifs en amont du cœur droit ou gauche. C’est au traitement de l’IC congestive que cet article s’intéresse, en étudiant successivement les éléments de physiopathologie de l’IC qui permettent de mieux comprendre le principe de la thérapeutique, puis les différentes classes de médicaments disponibles avant de proposer les schémas de traitement retenus en 2016 par la communauté scientifique.
La trop grande carence des traitements étiologiques ou spécifiques des cardiopathies laisse encore une large place à la bonne maîtrise de leur conséquence redoutée : l’IC congestive.
La thérapeutique cardiaque chez le chien présente une différence majeure avec celle du chat. Un nombre important de situations pathologiques cardiaques chez le chien font l’objet d’un consensus pour ce qui concerne leur prise en charge, en relation avec la médecine fondée sur les preuves. En revanche, chez le chat, les preuves sont encore trop controversées pour que se dégage un consensus quant aux meilleures solutions à adopter pour lutter contre son IC. L’IC féline est le sujet de la dernière partie de cet article.
Traitement de l’insuffisance cardiaque : principales classes thérapeutiques
Physiopathologie de l’insuffisance cardiaque
Notion de compensation et de décompensation
Toute maladie cardiaque (cardiopathie) induit une baisse du débit cardiaque. Mais cette baisse du débit est corrigée par la mise en place de phénomènes compensateurs cardiaques et périphériques : c’est la phase de compensation au cours de laquelle le cœur assure une perfusion normale des tissus (Fig. 1).
Les phénomènes compensateurs cardiaques comprennent principalement (Fig. 2) :
- une augmentation de la fréquence (chronotrope positif) et de la contractilité (inotrope positif) en partie par stimulation sympathique ;
- une augmentation de la précharge par rétention hydrosodée faisant suite à la stimulation du système rénine–angiotensine–aldostérone (SRAA) ;
- une hypertrophie (et/ou dilatation) myocardique (importance du SRAA). Les phénomènes compensateurs périphériques provoquent (Fig. 2) :
- une augmentation de la postcharge par vasoconstriction faisant suite à la stimulation du SRAA ;

- une redistribution du débit systémique vers les territoires coronariens et cérébraux par vasoconstriction artériolaire ;
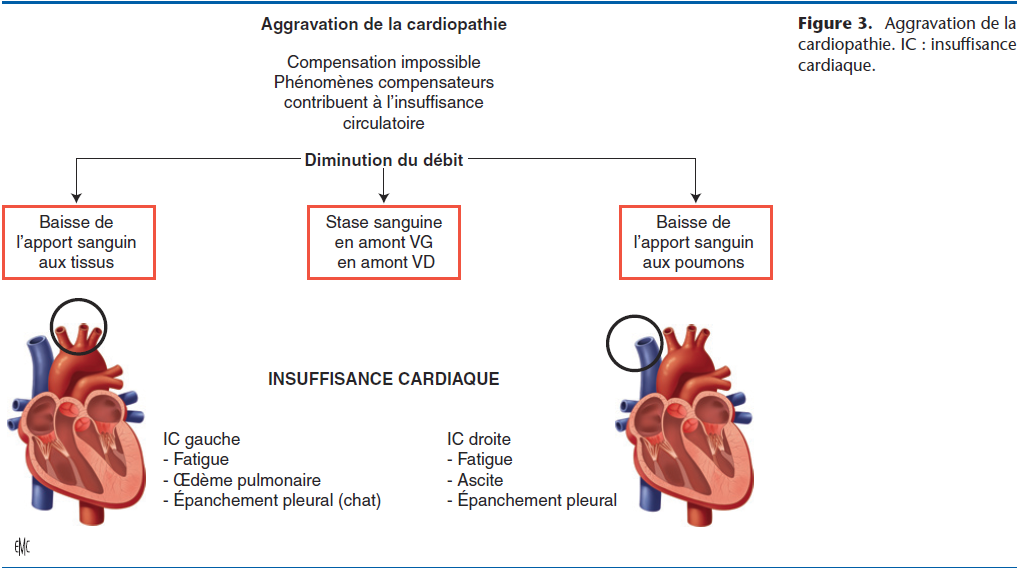
- une augmentation du cœfficient d’extraction de l’oxygène. Lors de cette phase et plus ou moins rapidement selon la gravité de la cardiopathie, les phénomènes compensateurs bénéfiques dans un premier temps ne peuvent éviter la chute du débit cardiaque et l’insuffisance circulatoire. Dans cette circonstance, non seulement ils ne sont plus utiles mais ils deviennent même délétères :
- la stimulation du système sympathique réduit le nombre de récepteurs bêtamyocardiques et leur sensibilité aux catécholamines ;
- l’augmentation de la fréquence cardiaque réduit le temps de remplissage diastolique ;
- l’augmentation de la précharge entraîne une dilatation cavitaire ;
- l’augmentation de la postcharge réduit le volume d’éjection systolique ;
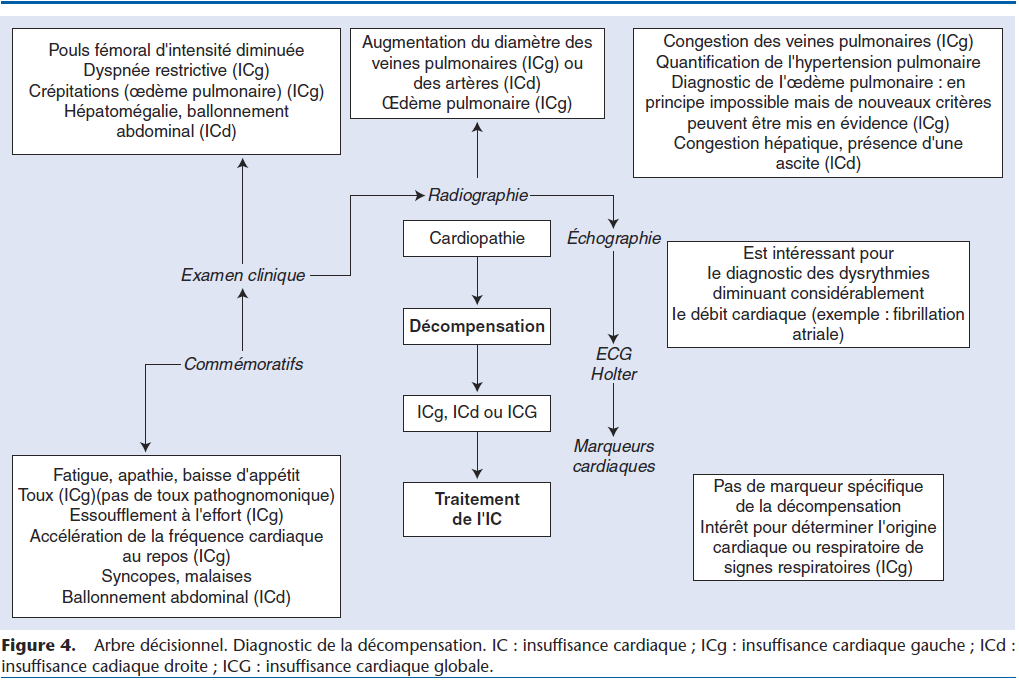
- les remodelages cardiaques et vasculaires majorent le travail cardiaque. Le syndrome « IC » se manifeste lorsque les phénomènes compensateurs n’arrivent plus à maintenir un débit cardiaque satisfaisant et deviennent alors nuisibles car aggravant les contraintes du cœur. C’est la phase de décompensation qui se caractérise par un déficit en aval du cœur et une stase sanguine en amont. Si la stase est en amont du cœur gauche, il s’agit d’une IC gauche, si la stase est en amont du cœur droit, il s’agit d’une IC droite (Fig. 3). L’IC globale (ICG) associe IC gauche et IC droite.
Classification de l’insuffisance cardiaque
L’IC a fait l’objet de très nombreuses études chez le chien. Bien que l’IC au sens strict caractérise la phase de décompensation, sa classification envisage les stades qui préludent à cette décompensation.
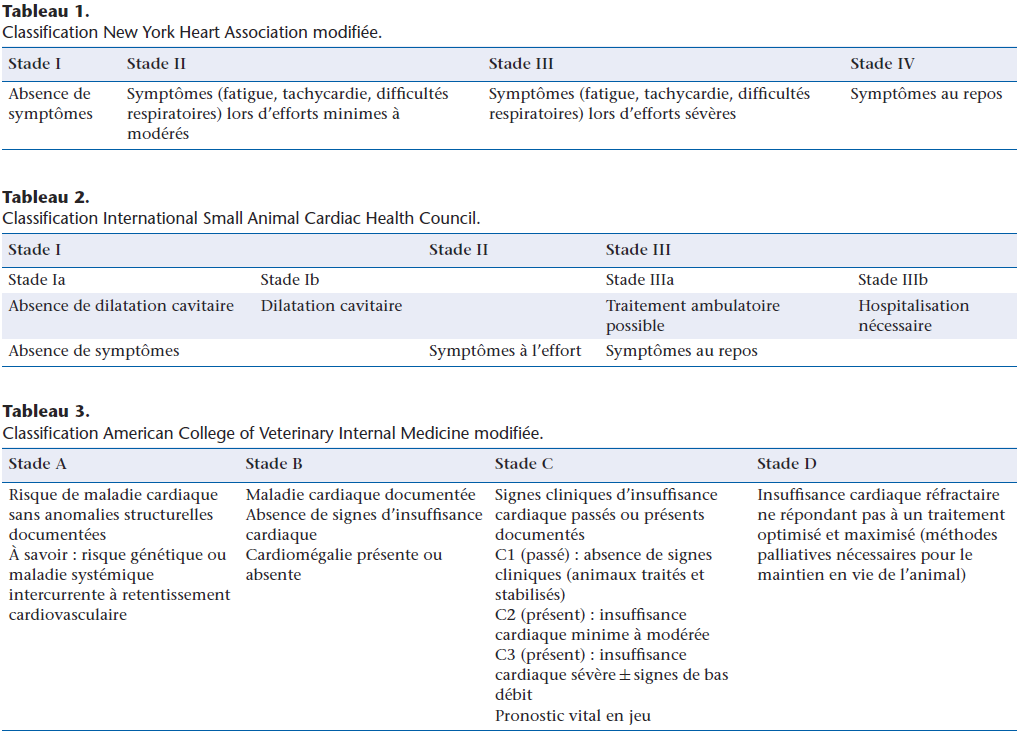
Plusieurs classifications ont été rédigées pour le chien, principalement basées sur les conséquences cliniques comme la classification NYHA de la New York Heart Association (Tableau 1), ou cliniques et échocardiographiques, telle la classification ISACHC de l’International Small Animal Cardiac Health Council (Tableau 2) de la maladie valvulaire mitrale dégénérative (MVD). Mais la classification la plus performante est sans conteste celle tirée de l’American College of Veterinary Internal Medicine (issue de l’American College of Cardiology [ACC] humain) : classification ACVIM modifiée (Tableau 3).
Cette dernière classification envisage les animaux présentant un risque de cardiopathie (stade A : exemple cavalier King Charles et MVD ; dogue allemand et cardiomyopathie dilatée [CMD]). Elle permet aussi de réserver une classe spéciale (C1) aux animaux ayant eu un épisode de décompensation mais dont le traitement a permis une régression totale des signes cliniques. Enfin, cette classification, bien que non établie ainsi, peut être extrapolée à toutes les cardiopathies et aussi au chat (par exemple, classe A pour le Maine Coon et la cardiomyopathie hypertrophique [CMH]).
Jusqu’à ces dernières années, l’ensemble des thérapeutiques utilisées pour le traitement de l’IC étaient indiquées dès que la décompensation était engagée. C’est dire toute l’importance que revêtait la détermination du début de la décompensation. Cette recherche demande la contribution d’un examen clinique complet et d’examens complémentaires résumés sur la Figure 4.

Plusieurs études indiquent que dans certaines circonstances, la prescription d’une composante du traitement de l’IC avant la décompensation a un intérêt pour retarder son déclenchement.
Suivre les signes cliniques de l’insuffisance cardiaque
Le traitement de l’IC nécessite une bonne connaissance de sa symptomatologie et de son évolution.
Lors d’IC gauche, la stase sanguine en amont du cœur provoque une augmentation de pression dans les cavités gauches, puis dans les veines et les capillaires pulmonaires. Cette congestion pulmonaire entraîne une extravasation de liquide (plasma) à travers la paroi des vaisseaux, puis l’interstitium pulmonaire, aboutissant à la formation d’un œdème pulmonaire interstitiel puis alvéolaire. Dyspnée restrictive puis expiratoire, densité radiographique liquidienne interstitielle puis alvéolaire (Fig. 5 à 7) sont recherchées par le clinicien. La détection de l’œdème pulmonaire ou de sa récidive est bien fréquence devient supérieure à 40 mouvements/min) et pas à la toux. Le détenteur de l’animal peut suivre la fréquence respiratoire et intervenir dans la gestion quotidienne du traitement pour contribuer à la normaliser.
L’IC gauche est également responsable d’une baisse du débit cardiaque en aval du cœur gauche et d’une mauvaise perfusion périphérique. Une insuffisance circulatoire gauche s’installe alors, qui peut être aiguë ou chronique. Cette insuffisance circulatoire se traduit cliniquement par une maigreur et des syncopes.
Lors d’IC droite, la stase sanguine provoque une augmentation des pressions dans les cavités droites, et dans les veines et les capillaires périphériques. Il existe alors une extravasation de liquide (plasma) à travers ces mêmes capillaires, conduisant à des œdèmes périphériques et des épanchements (abdominal ou pleural).
L’IC droite, responsable d’un déficit de la circulation de retour, entraîne alors une insuffisance circulatoire droite, qui peut être aiguë ou chronique, responsable de maigreur, apathie et anorexie.
Classes thérapeutiques
Le but principal du traitement de l’IC est de lutter contre les manifestations congestives, d’éviter leur récidive et de les prévenir. La cardiopathie et ses conséquences neurohormonales sont responsables de l’installation des signes congestifs. Les traitements étiologiques et spécifiques des cardiopathies étant malheureusement encore trop rares, la majorité des molécules utilisées s’opposent aux effets néfastes des mécanismes neurohormonaux. Ce contrôle nécessairement multiple puisque devant agir sur plusieurs systèmes, et ce, souvent de manière imparfaite, a pour double objectif l’augmentation de la qualité de vie et celle de la durée de vie.
Inhibiteurs de l’enzyme de conversion de l’angiotensine
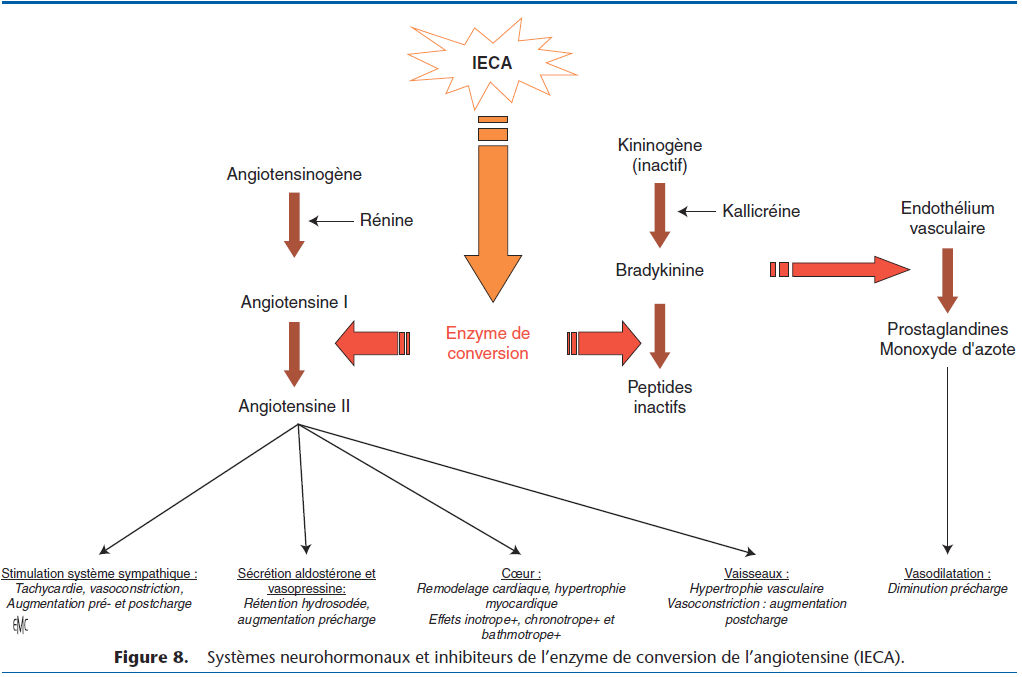
Les inhibiteurs de l’enzyme de conversion de l’angiotensine (IECA) sont des vasodilatateurs mixtes (artériels et veineux). Ils agissent par inhibition de l’enzyme de conversion, catalyseur de la réaction de formation d’angiotensine II à partir d’angiotensine I. Ils bloquent la synthèse d’angiotensine et s’opposent à tous ses effets. Ils contrôlent ainsi en partie les phénomènes compensateurs devenus délétères (Fig. 8) [1].
La réduction du retour veineux vers le cœur, de la pression diastolique intracardiaque et de la précharge permet de lutter contre la congestion et les œdèmes. La réduction de la résistance artérielle systémique, de la pression systolique intracardiaque et de la postcharge s’oppose à l’hypoperfusion tissulaire.
Leurs effets sont bénéfiques sur la qualité et la durée de vie. Ils peuvent être prescrits seuls ou en association avec d’autres molécules (diurétiques, digoxine, antiarythmique, autres vasodilatateurs [dérivés nitrés, inhibiteurs de la phosphodiestérase, inhibiteurs calciques]). Plusieurs molécules sont à la disposition des vétérinaires. Leur efficacité est presque identique, même si leur pharmacocinétique diffère sensiblement avec, en particulier, un rapport élimination urinaire/élimination hépatique variable.
L’amélioration se manifeste tardivement, entre 1 et 3 semaines après induction du traitement.
Il n’existe pas d’accoutumance.
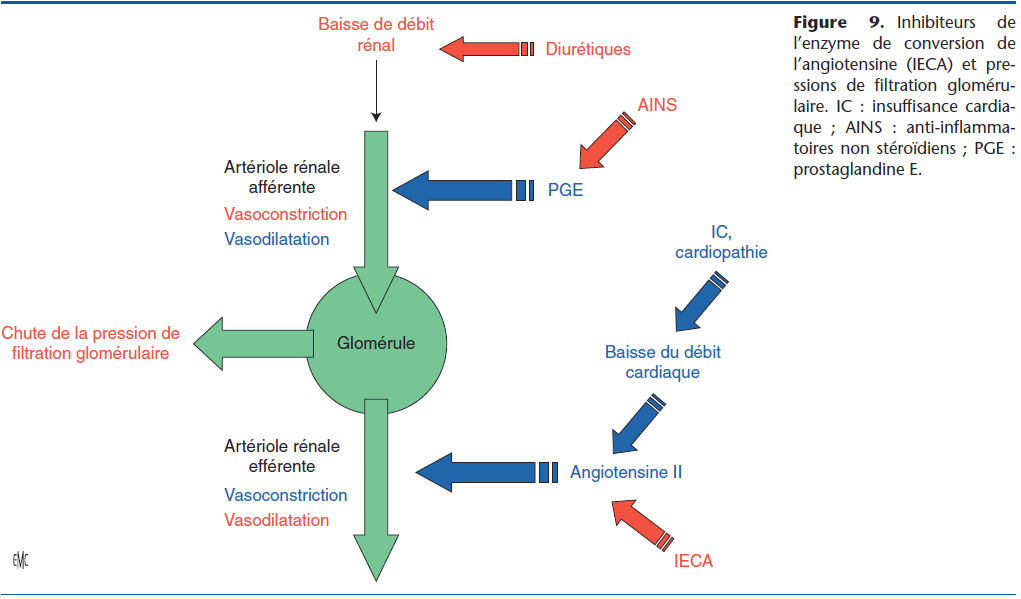
Les IECA ne semblent pas posséder de toxicité propre aux doses thérapeutiques (en particulier de toxicité rénale). Il existe néanmoins des contre-indications à leur utilisation : néphroangiosclérose (rare chez le chien), hypoaldostéronisme, hyponatrémie, hypovolémie, hypotension.
Il convient d’être prudent lors de toute situation associée à un bas débit rénal (IC à bas débit, déshydratation qu’elle soit iatrogène [excès de diurétique et/ou de vasodilatateur], ou consécutive à une autre affection [gastroentérite par exemple]). La vasodilatation provoquée par les IECA risque de majorer l’hypotension artérielle et d’induire une insuffisance rénale prérénale, voire rénale si celle-ci n’est pas corrigée (Fig. 9).
Lors de maladie valvulaire mitrale, les IECA sont indiqués dès l’apparition des premiers signes congestifs indiquant une décompensation (stade II classification NYHA, stade II classification ISACHC, stade C classification ACVIM) [2].
En 2016, il se dégage également une tendance pour considérer qu’ils peuvent avoir un effet bénéfique sur la durée de vie dans les stades asymptomatiques, c’est-à-dire prescrits précocement lors de l’identification d’une cardiopathie, mais non décompensée. Cette tendance est à nuancer car a priori race dépendante, le cavalier King Charles semblant faire exception à profiter de cet effet bénéfique sur la durée de vie, au contraire de toutes les autres races de chiens de petite taille [3].
Lors de CMD, ils sont indiqués dès l’identification de la maladie et le plus précocement possible [4]. Leur utilisation en phase de compensation de la maladie est recommandée, mais ne fait pas encore l’objet d’un consensus.
Diurétiques
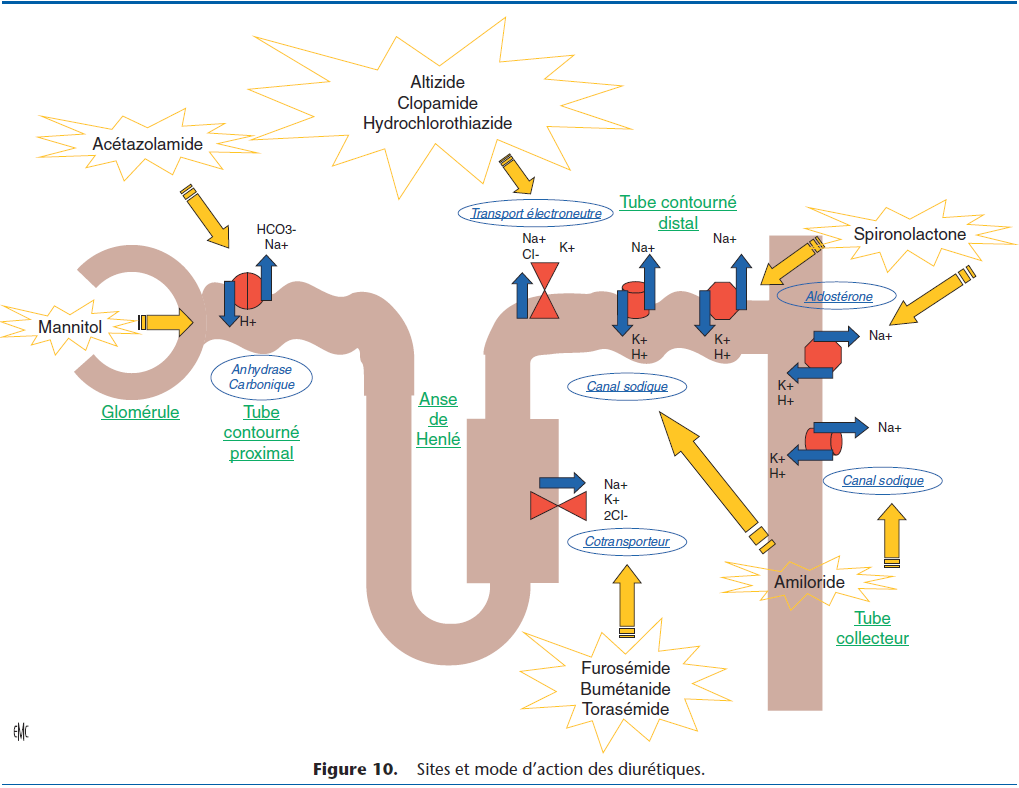
Les diurétiques sont des composés permettant la réduction des œdèmes en augmentant l’élimination urinaire du sodium. Chez l’insuffisant cardiaque, ils réduisent la précharge ventriculaire.
Ils agissent par inhibition de la réabsorption du sodium filtré dans le glomérule, dans des proportions variables selon les molécules et leur site d’action sur les tubules rénaux (Fig. 10).
L’utilisation d’un diurétique doit être raisonnée en fonction de l’indication et du mode d’action de la molécule. Par exemple, certains diurétiques sont potentiellement hypokaliémiants (diurétiques de l’anse, thiazidiques), d’autres sont « épargneurs du potassium » (antialdostérone, bloqueurs du canal sodique). La mise en place d’un traitement diurétique doit donc tenir compte de l’équilibre ionique du patient, en particulier du potassium (contrôlé régulièrement par l’ionogramme). Ceci est particulièrement important chez le chat, espèce très sensible aux variations de la kaliémie.
Les diurétiques sont indiqués dès l’apparition des signes congestifs :
- le furosémide : son effet salidiurétique est puissant et rapide. Par voie intraveineuse, la diminution de tension des fibres musculaires lisses des veines entraîne une vasodilatation rapide et très bénéfique lors d’œdème aigu pulmonaire, sa tolérance rénale est bonne et les risques d’hypokaliémie sont limités sauf chez le chat. En revanche, il peut provoquer une déshydratation extracellulaire et une hypovolémie capable de désamorcer la pompe cardiaque ou de stimuler le SRAA ;
- le torasémide : depuis 2016, ce nouveau diurétique de l’anse de la classe des pyridine-sulfonylurées est disponible. Le torasémide est sécrété dans la lumière des tubules via le système de transport d’acide organique sensible au probénécide. Le principal site d’action est la portion médullaire de la branche ascendante de l’anse de Henlé (Fig. 10). Comme pour le furosémide, l’inhibition de la réabsorption des ions sodium et chlorure entraîne non seulement une élimination de sel dans les urines, mais également une diminution de l’osmolarité interstitielle de la médulla rénale. Ceci entraîne une diminution de la réabsorption de l’eau libre, et par conséquent l’augmentation de son excrétion et de la production d’urine. Ce médicament n’est disponible que par voie orale, et sa durée d’action est plus longue que celle du furosémide, permettant une distribution une fois par jour. Une attention toute particulière doit être portée à la fonction rénale : une élévation des paramètres sanguins rénaux avec un risque d’insuffisance rénale est possible pendant le traitement. Ce risque semble augmenter avec l’accroissement des doses de torasémide. Une hémoconcentration et, très fréquemment, une polyurie et/ou une polydipsie sont observées. En cas de traitement prolongé, une insuffisance en électrolytes (notamment une hypokaliémie, une hypochlorémie, une hypomagnésémie) et une déshydratation peuvent survenir. Le torasémide est lié aux protéines plasmatiques. Cette liaison aux protéines plasmatiques facilite la sécrétion rénale du torasémide ; toute diminution de cette liaison par déplacement à l’utilisation d’un autre médicament peut provoquer une résistance au diurétique.
L’effet des antihypertenseurs, en particulier des IECA, peut être potentialisé lors d’administration concomitante au torasémide.
Lorsque le torasémide est administré en association avec d’autres traitements (les IECA, la digoxine par exemple), sa posologie peut nécessiter un ajustement selon la réponse thérapeutique de l’animal et les éventuels effets indésirables.
Un diurétique ne doit en revanche jamais être utilisé en monothérapie sur une longue période. La fuite urinaire sodique ainsi que l’hypovolémie qu’il entraîne favorisent la stimulation du SRAA, et en particulier avec la baisse de l’excrétion urinaire du sodium, effet contraire de celui recherché.
La dose efficace la plus faible possible est recherchée.
Dérivés nitrés
Les dérivés nitrés sont des vasodilatateurs principalement veineux. Ils permettent de lutter contre les signes congestifs en diminuant la précharge. À forte dose, ils sont aussi vasodilatateurs artériels, en particulier au niveau des artères coronaires, ce qui permet d’améliorer la perfusion myocardique.
Ils sont indiqués lors d’IC aiguë (traitement d’urgence de l’œdème aigu du poumon), lors d’ischémie myocardique et lors d’hypertension artérielle systémique.
Leur métabolisation est rapide, surtout par voie injectable, et leur durée d’action souvent brève. Leur principal effet secondaire est l’hypotension, constatée en début de traitement, surtout lors de fortes doses (traitement de l’urgence) ou lors d’une utilisation prolongée.
Chaque représentant de cette famille possède ses propres propriétés et indications :
le dinitrate d’isosorbide est principalement vasodilatateur veineux. Il est indiqué dans le traitement de l’IC chronique ;
la trinitrine, puissant vasodilatateur veineux, est surtout conseillée dans le traitement de l’urgence de l’œdème pulmonaire aigu. La forme pommade a disparu alors qu’elle était très utilisée en particulier chez le chat. Les formes « spray » sont moins pratiques et d’une efficacité incertaine ;
le nitroprussiate de sodium est un puissant vasodilatateur mixte d’action immédiate et très brève, indiqué dans le traitement d’urgence de l’œdème pulmonaire aigu et de l’hypertension artérielle. C’est un médicament à usage hospitalier car son administration par voie veineuse nécessite un monitoring humain et instrumental très attentif. Il est inscrit sur la liste des médicaments à rescription restreinte et les vétérinaires peuvent l’obtenir directement auprès du laboratoire producteur ;
la molsidomine est principalement un vasodilatateur coronarien. Elle est indiquée dans le traitement de l’ischémie myocardique et utilisée lors d’IC chronique. Elle n’a pas fait l’objet d’étude chez les carnivores.
Pimobendane
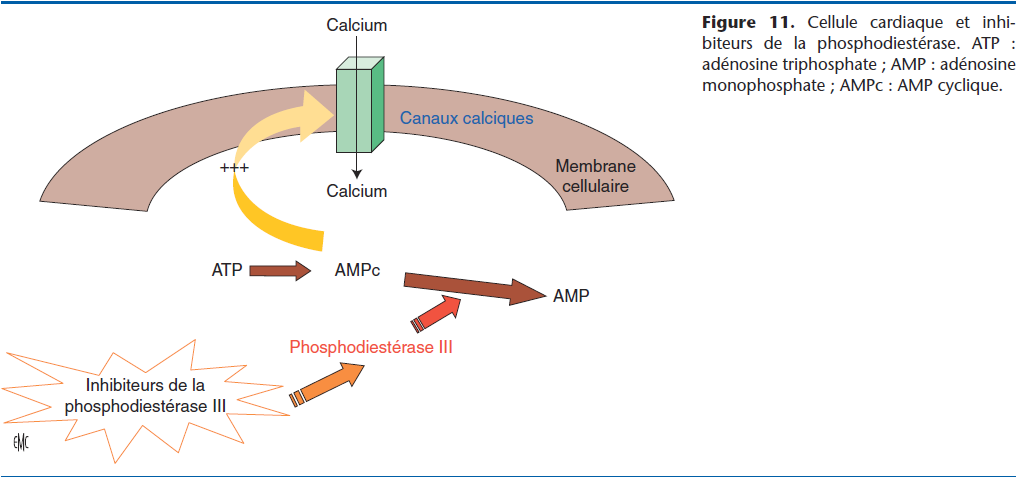
Le pimobendane est un agent inhibiteur des phosphodiestérases de type III et sensibilisateur calcique (Fig. 11). C’est un vasodilatateur systémique artériel, veineux et coronarien. Cette molécule possède également un effet inotrope positif sans augmentation de la concentration intracellulaire de calcium. Il est également lusitrope positif, et permet la diminution de la concentration du tumor necrosis factor alpha et des interleukines 1-bêta et 6 [5].
Ces effets placent le pimobendane parmi les molécules à préconiser pour le traitement de l’IC :
- la vasodilatation artérielle réduit la postcharge systémique et les pressions artérielles pulmonaires. La vasodilatation veineuse diminue la précharge (baisse de la pression veineuse hydrostatique) ;
- la vasodilatation coronarienne entraîne une meilleure oxygénation myocardique ;
- les effets inotropes positifs s’opposent à la chute de contractilité, présente précocement lors de CMD. Lors de maladie valvulaire chronique, il existe également une baisse de contractilité ;
- les effets lusitropes facilitent le remplissage diastolique.
Les effets secondaires potentiels sont des troubles digestifs mineurs dose-dépendants (ramollissement des selles, diarrhée modérée ou vomissements), des troubles rythmologiques d’apparition spontanée dose dépendants, une hypertrophie myocardique à dose élevée surtout lorsque le médicament n’est pas indiqué.
Son utilisation doit s’envisager dès la décompensation de l’IC (stade II classification NYHA, stade II classification ISACHC, stade C classification ACVIM) quelle que soit sa cause.
Lors de CMD, le pimobendane augmente la qualité de vie et la durée de vie d’un facteur 2 à 6 selon des études [4, 6]. Son pouvoir de retarder la décompensation a été prouvée pour la CMD du doberman [7].
Lors de maladie valvulaire mitrale, le pimobendane augmente la qualité de vie en réduisant environ de 30 % la survenue événements indésirables et augmente la durée de vie environ d’un facteur 2 [8]. De fac¸on très récente et sans encore avoir fait l’objet d’une publication, le laboratoire producteur de la molécule princeps du pimobendane annonce les résultats d’une vaste étude clinique montrant que ce médicament a la capacité de retarder la décompensation cardiaque lorsqu’il était prescrit lors de MVD avec remodelage cardiaque. Il sera donc d’un grand intérêt de considérer attentivement les résultats de l’étude EPIC.
Spironolactone
La spironolactone est un antagoniste compétitif de l’aldostérone sur les cellules tubulaires distales (tube contourné distal et tube collecteur). Elle inhibe la réabsorption du sodium et augmente la diurèse. Elle inhibe également la sécrétion des ions hydrogène et potassium dans la lumière tubulaire. Son effet salidiurétique est faible.
L’utilisation de cette molécule dans le traitement de l’IC est surtout liée à ses propriétés antifibrosantes car elle s’oppose aux effets fibrosants de l’aldostérone sur le myocarde, ce qui limite le remodelage et les phénomènes d’apoptoses délétères à terme pour la fonction cardiaque [9].
La spironolactone est indiquée lors de maladie valvulaire mitrale ou de CMD dès la phase de décompensation de l’IC (stade II classification NYHA, stade II classification ISACHC, stade C classification ACVIM). Elle augmente la qualité et la durée de vie. Le principe d’une prescription plus précoce en vue de retarder la décompensation est suggéré par son mécanisme d’action [9].
Antiarythmiques
Ces médicaments sont développés dans un autre article de l’EMC. Ils ne sont pas au sens strict une classe de médicaments de l’IC, mais ils sont très souvent associés à son traitement dans la mesure où les dysrythmies contribuent à la baisse du débit cardiaque. Ils ont, de plus, des propriétés collatérales sur l’inotropisme ou le tonus vasculaire, qui renforce ou au contraire contrarie l’action des autres médicaments de l’IC.
Le panel de médicaments possibles se réduit car de nouvelles techniques de traitement des troubles du rythme sont apparues. Les antiarythmiques fréquemment associés avec les autres classes thérapeutiques sont les suivants.
Digoxine
Hétéroside cardiotonique d’utilisation ancienne et répandue, la digoxine, molécule vagomimétique, ralentit le rythme cardiaque (effet chronotrope négatif) et la vitesse de conduction de l’influx nerveux intracardiaque (effet dromotrope négatif) ; elle augmente l’excitabilité du myocarde (effet bathmotrope positif, ventriculaire surtout), renforce la contractilité (effet inotrope positif) et le tonus du muscle cardiaque (effet tonotrope positif).
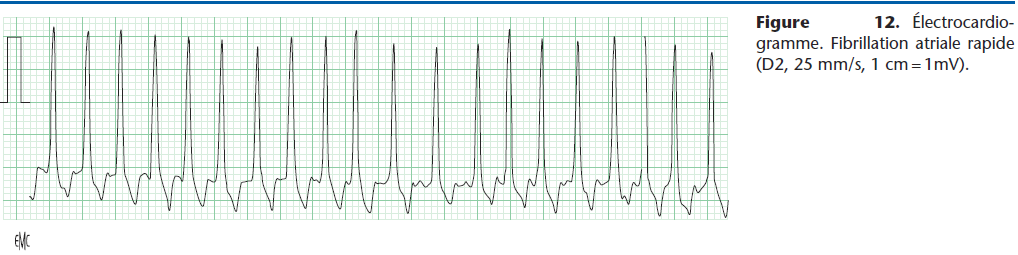
Elle aide à combattre les troubles supraventriculaires, qu’ils soient ou non consécutifs à des lésions de la fibre myocardique : tachycardie sinusale, extrasystolie supraventriculaire, tachycardie jonctionnelle et atriale, et surtout la fibrillation atriale rapide (Fig. 12). Cette dysrythmie très fréquente chez les chiens de grande race atteints de CMD n’est pas réduite par la digoxine, mais celle-ci provoque une diminution sensible de la fréquence cardiaque qui contribue à améliorer le débit cardiaque et l’état clinique de l’animal.
L’efficacité du traitement doit être contrôlée cinq jours au moins après son début.
Ses effets indésirables sont nombreux : troubles digestifs, troubles cardiaques (extrasystoles ventriculaires ou troubles de la conduction). Mais la fréquence de ces effets a beaucoup diminué depuis que la dose a été revue à la baisse : 0,005 à 0,010 mg/kg par jour en deux prises chez le chien et 0,010 mg/kg tous les deux jours chez le chat. La digoxinémie (1,5 à 2 ng/ml) peut être contrôlée pour confirmer un sur- ou sous-dosage.
Diltiazem
Cet inhibiteur calcique a un effet chronotrope négatif, bathmotrope négatif et inotrope négatif peu marqué et tolérable sur un cœur insuffisant.
Ses indications dans les troubles supraventriculaires sont assez similaires à celles de la digoxine (tachycardies supraventriculaires) avec laquelle elle peut être associée ; cette association a prouvé son efficacité pour ralentir la fréquence cardiaque lors de fibrillation atriale rapide [10]. Le diltiazem est généralement bien toléré.
Amiodarone
Les antiarythmiques de classe III prolongent la période réfractaire et créent des conditions défavorables au développement de circuits de réentrée. En comprimé ou sous forme injectable (médicament à prescription restreinte), l’amiodarone s’oppose aux dysrythmies à la fois supraventriculaires et ventriculaires, surtout si elles sont issues d’une réentrée. Des effets indésirables hépatiques (attention chez le doberman) [11] et une mauvaise tolérance par le cœur insuffisant de la forme injectable sont à redouter pour ce médicament dont la posologie est encore mal définie.
Sotalol
C’est un antagoniste non sélectif des récepteurs bêta 1 adrénergiques. Le sotalol commercialisé allonge comme l’amiodarone et les médicaments de la classe III la durée du potentiel d’action et de la période réfractaire du myocarde atrial et ventriculaire, et élève le seuil de déclenchement des fibrillations atriales et ventriculaires. Les propriétés bêtabloquantes du sotalol compléteraient l’effet « classe III » en modulant la stimulation du système nerveux autonome, qui favorise l’émergence des troubles ventriculaires.
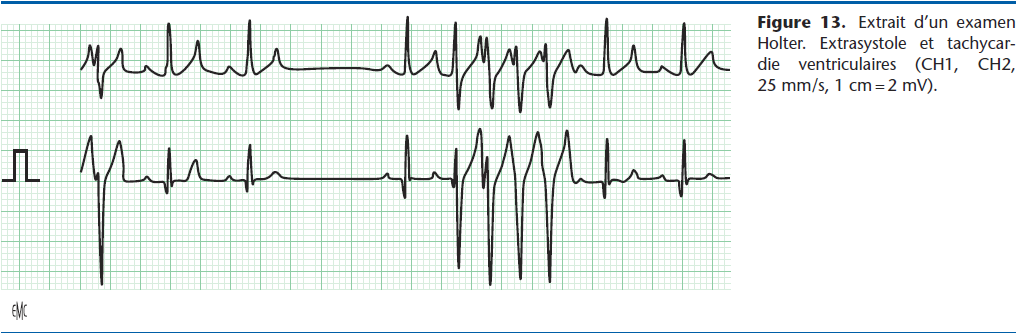
Depuis la disparition de l’aprindine et la mexilétine, le sotalol est devenu le médicament de référence pour traiter ou prévenir les tachycardies ventriculaires [12] (Fig. 13). Il est bien toléré, l’effet inotrope négatif étant moins marqué que celui du propranolol, et les risques de bradycardie et d’effet proarythmogène rares.
Autres médicaments
De nombreuses autres médicaments ont été, sont ou seront prescrits lors d’IC.
Les bêtabloquants utilisés récemment chez l’homme (exemple : carvédidol) ont été à l’origine d’espoirs non confirmés par les études engagées [13].
Le sildénafil est un vasodilatateur efficace pour lutter contre l’hypertension pulmonaire.
Des compléments alimentaires, taurine, carnitine, acides gras insaturés, etc. ont été proposés avec des succès divers pour traiter les cardiopathies responsables d’IC ou l’IC elle-même.
Associations de molécules dans le même médicament
Elles connaissent un véritable essor car elles facilitent grandement l’observance. Leur inconvénient majeur est de ne plus permettre le choix de la dose de leurs composants. Bénazépril et spironolactone sont ainsi associés, et pimobendane et bénazépril, sans qu’une étude clinique ne démontre le bénéfice de cumuler ces deux classes thérapeutiques.
Mise en œuvre des traitements
Le traitement d’un animal insuffisant cardiaque répond à certaines règles qui permettent la mise en œuvre des différentes classes de molécules. Cette mise en œuvre est raisonnée en fonction principalement du stade de l’IC. Bien que déterminant, ce critère n’est pas le seul à prendre en compte. D’autres s’y associent, qui indiquent ou contre-indiquent certaines molécules. En particulier, l’origine de l’IC (maladie causale), la présence de maladies intercurrentes (affections rénale, hypertensive, ostéoarticulaire, tumorale, etc.), les effets secondaires ou indésirables médicamenteux, etc.
Ainsi, la mise en œuvre d’un traitement apparaît de plus en plus « variée ». Chaque animal devient rapidement un cas unique pour lequel le traitement est adapté de fac¸on personnalisée. Les grands principes classiques de cette mise en œuvre se réduisent à des principes de base à partir desquels s’élabore une réflexion pour chaque cas, permettant d’aboutir alors à un choix thérapeutique adapté à l’animal consulté.

Des schémas généraux thérapeutiques de l’IC sont ainsi rédigés dans leurs grandes lignes à partir des classifications précédentes ou à partir des symptômes présentés par l’animal. Les protocoles déjà performants issus de la classification ISACHC (Tableau 4) ont été bouleversés par la nouvelle classification ACVIM, par la parution des recommandations concernant le traitement de la maladie mitrale dégénérative [2], par la mise à disposition de nouveaux médicaments ou de nouvelles indications pour les médicaments existants (Tableau 5).

Schéma thérapeutique « ISACHC »
Dans ce schéma thérapeutique issu de la classification ISACHC apparaît l’absence de traitement nécessaire en stade 1 de la maladie. Cette notion n’est actuellement pas consensuelle et semblerait être race-dépendante (cf.supra).
Cette classification est celle qui a été la plus usitée pour les études cliniques qui préludent à la délivrance de l’autorisation de mise sur le marché pour les médicaments de l’IC.
Schéma thérapeutique « ACVIM » modifiée
Lors d’IC secondaire à une maladie valvulaire mitrale, des recommandations de traitement ont été rédigées par un comité d’experts issu de l’ACVIM, qui a réalisé une analyse selon une méthode de médecine factuelle (evidence-based medecine). Pour chaque stade de la maladie valvulaire mitrale se rapportant à la classification ACC, le comité a rassemblé et évalué, en quantité comme en qualité, les données scientifiques concernant le traitement. Pour chaque recommandation qui en découle, le comité a spécifiquement indiqué si tous les membres étaient d’accord (consensus) ou s’il y avait des divergences d’opinion sur ce point (absence de consensus), en précisant dans ce cas les motifs du désaccord.
Ces recommandations peuvent en fait s’appliquer à l’IC congestive quelle que soit son origine. Ils sont résumés dans le Tableau 6, qui indique en plus les différences de protocole pour chacune des deux entités les plus rencontrées en médecine canine : la MVD et la CMD.
Dans ces schémas thérapeutiques issus de la classification ACVIM apparaissent des axes de suivi et de gestion globale du cas (prévention, surveillance, etc.), en plus des recommandations thérapeutiques.
Polythérapie
La polythérapie est quasiment toujours obligatoire en cardiologie. Le traitement de l’IC est un véritable défi car il associe non seulement plusieurs classes thérapeutiques de l’IC mais, fréquemment, il nécessite de lui adjoindre les traitements d’autres affections.
Les effets bénéfiques mais également indésirables de ces « mélanges » sont parfois connus, mais pour un grand nombre d’entre eux la médecine fondée sur les preuves n’a pas encore bien défini les limites. De plus, les maladies intercurrentes, fréquentes par exemple chez le chien âgé, créent une sensibilité individuelle qui impose au clinicien une surveillance très régulière. Un suivi périodique à intervalles réguliers comportant des examens complémentaires pour suivre l’évolution de l’IC, mais aussi des examens biologiques pour vérifier la bonne tolérance des médicaments, s’impose. Leur fréquence dépend évidemment du stade l’IC et ils doivent être programmés au minimum à la fin de chaque consultation.
Observance
Un autre obstacle corollaire de cette polythérapie est la mauvaise observance. Les médicaments de plus en plus appétants aident à en diminuer l’impact, mais le clinicien doit systématiquement envisager avec le détenteur de l’animal le respect de l’observance et faire évoluer sa prescription en fonction des caractéristiques comportementales de l’animal.
L’éducation thérapeutique du maître est également une notion importante en cardiologie. Elle permet, par exemple, de révéler précocement les éventuels effets indésirables et de les contrer plus rapidement, ou d’adapter une dose de médicaments quotidiennement.
Cas particulier du chat
Les cardiomyopathies représentent la grande majorité des affections cardiaques du chat et parmi celles-ci, la CMH est de loin la plus fréquente.
Les cardiomyopathies félines représentent un groupe hétérogène de maladies musculaires cardiaques dans cette espèce, illustré par de nombreuses formes différentes : hypertrophiques, dilatées, restrictives, arythmogènes, non classées. Chaque forme présente des spécificités d’anomalies et des modifications morphologiques et hémodynamiques, avec des conséquences et manifestations variables. L’issue la plus fréquente de l’ensemble des cardiomyopathies félines est l’IC. En 2016, il y a peu d’études qui évaluent l’efficacité des traitements des cardiomyopathies félines, ainsi que la prise en compte du suivi de ces maladies et des animaux traités sur les moyen et long termes.
En dehors du traitement de l’IC congestive, il n’existe pas de consensus en 2016 permettant de décider la mise en place ou non d’un traitement lors de cardiomyopathie féline, et encore moins lorsqu’elle est asymptomatique.
Cardiomyopathies félines : quels traitements en phase asymptomatique ?
Seul le traitement des formes hypertrophiques est envisagé ici.
Une enquête [14] indique que la mise en place d’un traitement n’apparaît pas nécessaire lors de cardiomyopathie asymptomatique « simple ». En revanche, si cette dernière s’associe à d’autres éléments péjoratifs (comme par exemple une dilatation atriale gauche ou un mouvement systolique antérieur de la valve mitrale), le traitement semble pertinent. Les traitements les plus utilisés lorsque l’atrium gauche est dilaté sont les bêtabloquants (50 % des cliniciens), les IECA (25 %), le diltiazem (10 %), les antiagrégants plaquettaires (20 %). Lorsqu’un mouvement systolique antérieur mitral est présent, le traitement majoritaire utilise les bêtabloquants (94 % des cliniciens). L’intention de traiter ou de ne pas traiter ainsi que le choix d’un traitement sont subjectifs, en l’absence d’études pertinentes et fiables standardisant un protocole particulier, et en l’absence de l’observation d’effets des différents traitements en phase asymptomatique. Lors d’IC, les bêtabloquants sont peu utilisés, au profit du diltiazem (inhibiteur calcique).
Bêtabloquants ou inhibiteurs calciques ?
Les bêtabloquants sont utilisés pour diminuer les conséquences du mouvement systolique antérieur mitral, de l’obstruction dynamique de la chambre de chasse ventriculaire gauche ou bien de l’hypertrophie myocardique concentrique. L’aténolol est la molécule la plus prescrite, mais son efficacité n’est probablement pas à la hauteur des espoirs. Une étude [15] indique l’absence d’effets de cette molécule sur la mortalité, par rapport à l’absence de traitement, sur une période de suivi de plus de cinq ans.
Le diltiazem, inhibiteur calcique, a des effets lusitropes positifs qui améliorent la relaxation myocardique en fin de systole. Bien qu’ayant été largement utilisé depuis de nombreuses années et disposant même d’une autorisation de mise sur le marché (AMM) vétérinaire, son bénéfice n’est pas clairement démontré.
Inhibiteurs de l’enzyme de conversion de l’angiotensine
Il est possible que les IECA réduisent significativement l’hypertrophie ventriculaire gauche et améliorent le remplissage diastolique. Aucune preuve n’est disponible pour le moment de cette propriété intéressante [16].
Inhibiteurs de l’aldostérone
Jusqu’en 2016, aucun effet bénéfique n’a été observé avec cette molécule, considérant des paramètres d’évaluation échocardiographiques (masse ventriculaire gauche, fonction diastolique, taille de l’atrium gauche) [17]. Un risque de dermatite faciale est possible chez certains chats faisant suite à la prise de spironolactone.
Anticoagulants et antiagrégants plaquettaires
Lorsque l’atrium gauche est dilaté ou que des volutes préthrombiques sont visibles, la prescription d’antiagrégants plaquettaires est proposée mais sans justification démontrée.
Ivabradine
L’ivabradine est une nouvelle molécule, chronotrope négative, agissant par bocage des funny-channels du nœud sinusal. Ses effets de réduction de la fréquence cardiaque, et par conséquent d’amélioration du remplissage diastolique, ainsi que la réduction de l’obstruction dynamique, semblent intéressants, mais nécessitent de plus amples évaluations [18, 19].
Cardiomyopathies félines : quels traitements en phase symptomatique ?
La phase symptomatique est principalement caractérisée par des manifestations d’IC congestive gauche. Les traitements de choix sont les diurétiques de l’anse, principalement le furosémide (le torasémide est une molécule en cours d’évaluation), et les IECA. Les autres molécules précédemment développées n’ont pas montré d’effets bénéfiques chez ces animaux. Il apparaît même que certaines soient délétères, comme l’aténolol, augmentant la mortalité (Fox P., données non publiées).
Bien qu’il n’ait pas d’AMM pour cette espèce, le pimobendane peut être prescrit et utilisé chez le chat en complément d’autres molécules lors de cardiopathie et d’IC. Les médianes de survie ainsi obtenues sont mesurées entre 151 jours (chats insuffisants cardiaques, toutes cardiopathies confondues) [20] et 167 jours (chats insuffisants cardiaques, avec une dysfonction systolique, toutes cardiopathies confondues) [21]. Lors de CMH avec IC, il améliore l’espérance de vie, avec une médiane à 626 jours (contre 103 jours en l’absence de pimobendane) [22]. C’est également le cas lors de CMD, maladie rarement rencontrée actuellement chez le chat, avec une médiane de survie à 49 jours versus 12 jours sans cette molécule [23]. De plus amples études sont nécessaires afin de préciser ses indications et ses effets (différentes formes de cardiomyopathies, stades de l’IC, effets en phases asymptomatiques ?). Néanmoins, il apparaît intéressant de considérer cette molécule dans l’arsenal thérapeutique des maladies cardiaques avec IC chez le chat.
Traiter un chat qui présente une cardiomyopathie reste un défi pour le praticien, ne disposant pas d’un nombre d’études suffisamment probantes ou standardisées. Les enquêtes réalisées sur les habitudes de traitements des praticiens révèlent un rôle prépondérant de l’expérience personnelle. Le suivi du traitement de ces animaux et ses adaptations sont individuels, évalués au cas par cas, en fonction de l’évolution de l’état clinique du chat et des résultats des examens complémentaires.
Conclusion
La thérapeutique de l’IC a considérablement évolué grâce à un meilleur diagnostic, à l’apparition de nouveaux médicaments, à plusieurs études cliniques permettant de mieux bien connaître leurs effets bénéfiques et indésirables, et souvent leurs interactions, données particulièrement intéressantes puisque la polythérapie en cardiologie est plus que fréquente. Il reste encore de nombreuses inconnues. Le traitement des cardiomyopathies félines est au centre des préoccupations des cardiologues vétérinaires, mais la grande diversité de leurs phénotypes complique beaucoup la réalisation des études cliniques nécessaires pour objectiver l’efficacité du traitement envisagé.
Références[1] Kirk RW, Bonagura J. Current veterinary therapy. Small animal practice XI. Philadelphia: Saunders; 1992. [2] Atkins C, Bonagura J, Ettinger S, Fox P, Gordon S, Haggstrom J, et al. Guidelines for the diagnosis and treatment of canine chronic valvular heart disease. J Vet Intern Med 2009;23:1142–50. [3] Pouchelon JL, Jamet N, Gouni V, Tissier R, Serres F, Carlos Sampedrano C, et al. Effect of benazepril on survival and cardiac events in dogs with asymptomatic mitral valve disease: a retrospective study of 141 cases. J Vet Intern Med 2008;22:905–14. [4] O’Grady MR, Minors SL, O’Sullivan ML, Horne R. Effect of pimobendan on case fatality rate in Doberman Pinschers with congestive heart failure caused by dilated cardiomyopathy. J Vet Intern Med 2008;22:897–904. [5] Iwasaki A, Matsumori A, Yamada T, Shioi T, Wang W, et al. Pimobendan inhibits the production of proinflammatory cytokines and gene expression of inductible nitric oxide synthase in a murine model of virale myocarditis. J Am Coll Cardiol 1999;33:1400–7. [6] Fuentes VL, Corcoran B, French A, Schober KE, Kleemann R, Justus C. A double-blind, randomized, placebo-controlled study of pimobendan in dogs with dilated cardiomyopathy. J Vet Intern Med 2002;16:255–61. [7] Summerfield NJ, Boswood A, O’Grady MR, Gordon SG, Dukes-McEwan J, Oyama MA, et al. Efficacy of pimobendan in the prevention of congestive heart failure or sudden death in Doberman Pinschers with preclinical dilated cardiomyopathy (The PROTECT Study). J Vet Intern Med 2012;26:1337–49. [8] Häggström J, Boswood A, O’Grady M, Jöns O, Smith S, Swift S, et al. Longitudinal analysis of quality of life, clinical, radiographic, echocardiographic, and laboratory variables in dogs with myxomatous mitral valve disease receiving pimobendan or benazepril: the QUEST study. J Vet Intern Med 2013;27:1441–51. [9] Bernay F, Bland JM, Häggström J, Baduel L, Combes B, Lopez A, et al. Efficacy of spironolactone on survival in dogs with naturally occurring mitral regurgitation caused by myxomatous mitral valve disease. J Vet Intern Med 2010;24:331–41. [10] Gelzer AR, Kraus MS, Rishniw M, Moïse NS, Pariaut R, Jesty SA, et al. Combination therapy with digoxin and diltiazem controls ventricular rate in chronic atrial fibrillation in dogs better than digoxin or diltiazem monotherapy: a randomized crossover study in 18 dogs. J Vet Intern Med 2009;23:499–508. [11] Kraus MS, Thomason JD, Fallaw TL, Calvert CA. Toxi-city in Doberman Pinchers with ventricular arrhythmias treated with amiodarone (1996-2005). J Vet Intern Med 2009;23:1–6. [12] Meurs KM, Spier AW, Wright NA, Atkins CE, DeFrancesco TC, Gordon SG, et al. Comparison of the effects of four antiarrhythmic treatments for familial ventricular arrhythmias in Boxers. J Am Vet Med Assoc 2002;221:522–7. [13] Marcondes-Santos M, Tarasoutchi F, Mansur AP, Strunz CM. Effects of carvedilol treatment in dogs with chronic mitral valvular disease. J Vet Intern Med 2007;21:996–1001. [14] Rishniw M, Pion PD. Is treatment of feline hypertrophic cardiomyopathy based in science or faith? A survey of cardiologists and a literature search. J Feline Med Surg 2011;13:487–97. [15] Schober KE, Zientek J, Li X, Fuentes VL, Bonagura JD. Effect of treatment with atenolol on 5-year survival in cats with preclinical (asymptomatic) hypertrophic cardiomyopathy. J Vet Cardiol 2013;15:93–104. [16] Taillefer M, Di Fruscia R. Benazepril and subclinical feline hypertrophic cardiomyopathy: a prospective, blinded, controlled study. Can Vet J 2006;47:437–45. [17] MacDonald KA, Kittleson MD, Kass PH, White SD. Effect of spironolactone on diastolic function and left ventricular mass in Maine Coon cats with familial hypertrophic cardiomyopathy. J Vet Intern Med 2008;22:335–41. [18] Riesen SC, Schober KE, Smith DN, Otoni CC, Li X, Bonagura JD. Effects of ivabradine on heart rate and left ventricular function in healthy cats and cats with hypertrophic cardiomyopathy. Am J Vet Res 2012;73:202–12. [19] Blass KA, Schober KE, Li X, Scansen BA, Bonagura JD. Acute effects of ivabradine on dynamic obstruction of the left ventricular outflow tract in cats with preclinical hypertrophic cardiomyopathy. J Vet Intern Med 2014;28:838–46. [20] Macgregor JM, Rush JE, Laste NJ, Malakoff RL, Cunningham SM, Aronow N, et al. Use of pimobendan in 170 cats (2006-2010). J Vet Cardiol 2011;13:251–60. [21] Gordon SG, Saunders AB, Roland RM, Winter RL, Drourr L, Achen SE, et al. Effect of oral administration of pimobendan in cats with heart failure. J Am Vet Med Assoc 2012;241:89–94. [22] Reina-Doreste Y, Stern JA, Keene BW, Tou SP, Atkins CE, DeFrancesco TC, et al. Case-control study of the effects of pimobendan on survival time in cats with hypertrophic car-diomyopathy and congestive heart failure. J Am Vet Med Assoc 2014;245:534–9. [23] Hambrook LE, Bennett PF. Effect of pimobendan on the clinical outcome and survival of cats with non-taurine responsive dilated cardiomyopathy. J Feline Med Surg 2012;14:233–9. |